分子结构
| 此条目需要精通或熟悉相关主题的编者参与及协助编辑。 (2015年12月14日) |
| 此条目需要补充更多来源。 (2013年3月5日) |
分子结构,或称分子立体结构、分子形状、分子几何、分子几何构型,建立在光谱学数据之上,用以描述分子中原子的三维排列方式。分子结构在很大程度上影响了化学物质的反应性、极性、相态、颜色、磁性和生物活性。[1][2][3]
分子结构最好在接近绝对零度的温度下测定,因为随着温度升高,分子转动也增加。量子力学和半实验的分子模拟计算可以得出分子形状,固态分子的结构也可通过X射线晶体学测定。体积较大的分子通常以多个稳定的构象存在,势能面中这些构象之间的能垒较高。
温度对其的影响
由于分子中原子的运动由量子力学决定,因此“运动”这个概念也必须要建立在量子力学基础之上。总体(外部)的量子力学运动——如平移和旋转几乎不改变分子的结构(由旋转导致的科里奥利力和离心扭曲以及由此导致的形状变化在此可以忽略)。内部运动包括振动,隶属于谐波,即原子即使在绝对零度仍会在平衡间振荡。此时所有原子都处于振动基态,具有零点能量,振动模式的波函数也不是一个尖峰,而是有限宽度的指数。随着温度升高,振动模式(自由度)被热激发,用通俗的话讲是分子振动加快,而它们仍然只在分子特定部分振荡。
玻尔兹曼分布可以量度温度对分子振动的影响: ,其中 是振动模式的激发能, 是玻尔兹曼常数, 是绝对温度。在298K(25 °C)下,典型的玻尔兹曼因子值为:ΔE = 500 cm-1 → 0.089;ΔE = 1000 cm-1 → 0.008;ΔE = 1500 cm-1 → 7 * 10-4。即,如果激发能为500 cm-1,那么大约9%的分子在室温时会处于热激发态。对水分子而言,其弯曲模式具有最低的激发能,大约为1600 cm-1,因此室温下水分子中振动速度比绝对零度时快的分子占不到0.07%。
虽然转动很难影响分子结构,但作为一个量子力学运动,相对振动而言它在低温下热激发程度较高。从经典力学角度来看即是,更多分子在高温下转动更快(它们具有更大的角速度和角动量);而从量子力学角度看则是,随温度升高,更多角动量较大的本征态开始聚集。典型的转动激发能数量级在几cm-1。
由于涉及转动态,很多光谱学的实验数据都被扩大了。而转动运动随温度升高而变得激烈,因此,低温下的分子结构数据往往更加可靠,而从高温下的光谱很难得出分子结构。
成键
根据定义,分子中的原子是由共价键连结起来的,包括单键、双键、叁键等(另一种原子的成键方法被成为离子键,并且涉及一个正的阳离子和一个负的阴离子)。
因此分子形状可通过键长、键角和二面角这些参数来阐明。键长被定义为任何分子中,两个原子中心间的平均距离;键角是相邻三个原子两条键之间的夹角;而二面角,或称扭转角,则相对于四个相邻原子而言,是前三个原子所形成的平面与剩下一根键之间所成的角度。
电子的量子力学性质决定分子结构,因此可通过价键理论近似来理解化学键类型对结构的影响。杂化轨道理论认为,先有原子轨道间的杂化,才有化学键的生成。至于化学键,其中两种最常见的为σ键和π键,而含离域电子的结构可借助分子轨道理论来理解。
研究原子和分子中电子的类波行为隶属于量子化学的范畴。
异构体
具有相同化学式但不同结构的物质被称为异构体,它们常有不同的性质。
- 纯净物只由异构体中的一种构成,因此所有分子结构相同。
- 结构异构体中原子排列顺序不同,性质也常有不同,例如正丙醇和异丙醇。
- 官能团异构体是由于含有不同官能团而导致异构的异构体,例如醚和醇。
- 立体异构体物理性质可能类似(例如熔点和沸点),但生化活性一般不同。这是由于它们具有手性,必须要有特定的立体结构才可以与其他底物结合。一对立体异构体可使偏振光偏转相同的角度,但是在相反方向上。
- 蛋白质折叠关系到高分子蛋白质的构象取向问题。
分子结构类型
分子有六种基本形状类型:
- 直线型:所有原子处在一条直线上,键角为180°,例如二氧化碳 。
- 平面三角形:所有原子处在一个平面上,三个周边原子均匀分布在中心原子周围,键角120°,例如三氟化硼 。
- 四面体:四个周边原子处在四面体的四个顶点,中心原子位于四面体中心。理想键角 ,例如甲烷 。
- 八面体:六个周边原子处在八面体的六个顶点,中心原子位于四面体中心。理想键角90°,例如六氟化硫SF6。
- 锥形
- 三角锥:四面体型的一条键被孤对电子占据,剩下三条键的形状即是三角锥型。由于孤对电子体积较大,三角锥形的键角较四面体形的键角要小。例如氨 ,键角107.3°。
- 四方锥:八面体型的一条键被孤对电子占据,剩下五条键的形状即是四方锥型,例如五氟化溴 。
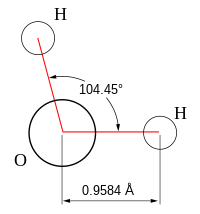
- 角形:与直线型相对,两条键的三个原子不在一条直线上。例如水H2O,键角104.5°。
除了上述的基本类型外,也存在以下的分子结构:
- T形:此分子构型描述其中央原子有着三个配基的化合物形状,二个键位于一直线上,另一个键则和上述二个键垂直,因此形成T形的结构,例如三氟化氯 。根据价层电子对互斥理论,T形分子构型是三个配基和两个中央原子的孤电子对相互作用造成的结果。
- 三帽三角棱柱:分子构型描述有九个原子、原子基团或配基被安排在一个中心原子周围的形状,利用三侧锥三角柱(一个有着和三个矩形面相接触的额外原子的三角柱)定义此种分子的顶点。这和帽状方形反棱柱分子构型非常相似,并且在某些分子中对于此特定的几何构型展现出一些争议。九氢合铼(VII)酸钾中的九氢合铼(VII)酸根离子 通常被视为拥有三帽三角棱柱分子构型,虽然有时此几何构型用帽状方形反棱柱分子构型所取代。
- 三角棱形:分子构型描述有六个原子、原子基团或配基被安排在一个中心原子周围的形状,利用三角柱定义此种分子的顶点。
- 五角平面:分子构型描述有五个原子、原子基团或配基被安排在一个中心原子周围的形状,利用五角型定义此种分子的顶点。
- 五角锥:分子构型描述有六个原子、原子基团或配基被安排在一个中心原子周围的形状,利用五角锥形定义此种分子的顶点。这是有着不均匀键角的少数分子键的其中一种。
- 帽状方形:反棱柱分子构型描述有八个原子、原子基团或配基被安排在一个中心原子周围的形状,利用正四角锥反角柱定义此种分子的顶点。 正四角锥反角柱是一种有着正四角反棱柱的四角锥去连接到方形的底部。在这方面,这可以被看成“覆盖的”正四角反棱柱(一个有着锥体竖立在某个方形面的正四角反棱柱)。这和三帽三角棱柱分子构型非常相似,并且在某些分子中对于此特定的几何构型展现出一些争议。九氢合铼(VII)酸根 有时被视为拥有帽状方形反棱柱分子构型,虽然有时她的几何构型用三帽三角棱柱分子构型所取代。
- 扭曲或覆盖孤电子对的八面体:分子构型描述有六个原子、原子基团或配基被安排在一个中心原子周围的形状(有着一电子对覆盖着八面体),利用两个倒立相连的三角锥形定义此种分子的顶点。这种形状有着分子对称性。
- 方形反棱柱分子构型:有八个原子、原子基团或配体连接在一个中心原子周围的分子构型,其分子形状类似正四角反棱柱。像八氟合氙(VI)酸亚硝酰 中的八氟合氙(VI)酸根离子 离子即为此构型。
- 跷跷板形:或称蝴蝶骨型,是一种和中央原子有四个键结并拥有C2v对称性的分子构型,名称"跷跷板"的来源是因为其在观察中看起来像跷跷板。和中央原子有四个键结的构型中,最常见的为四面体,或是较少见的,方形平面构型,所以跷跷板形分子构型就像他的名字一样,是很少见的。
| 键连原子 | 孤对电子 | 电子对数 | 形状 | 理想键角 | 例子 | 图片 |
|---|---|---|---|---|---|---|
| 2 | 0 | 2 | 直线形 | 180° | CO2 | |
| 3 | 0 | 3 | 平面三角形 | 120° | BF3 | |
| 2 | 1 | 3 | 角形 | 120° (119°) | SO2 | |
| 4 | 0 | 4 | 四面体形 | 109.5° | CH4 | |
| 3 | 1 | 4 | 三角锥形 | 107° | NH3 | |
| 2 | 2 | 4 | 角形 | 109.5° (104.5°) | H2O | |
| 5 | 0 | 5 | 三角双锥形 | 90°, 120°, 180° | PCl5 | |
| 4 | 1 | 5 | 变形四面体形 | 180°, 120°, 90° (173.1°, 101.6°) | SF4 | |
| 3 | 2 | 5 | T字形 | 90°, 180° (87.5°, < 180°) | ClF3 | |
| 2 | 3 | 5 | 直线形 | 180° | XeF2 | |
| 6 | 0 | 6 | 八面体形 | 90°, 180° | SF6 | |
| 5 | 1 | 6 | 四角锥形 | 90° (84.8°), 180° | BrF5 | |
| 4 | 2 | 6 | 平面四方形 | 90°, 180° | XeF4 | |
| 7 | 0 | 7 | 五角双锥形 | 90°, 72°, 180° | IF7 | |
| 6 | 1 | 7 | 五角锥形 | 72°, 90°, 144° | XeOF5− | |
| 5 | 2 | 7 | 平面五角形 | 72°, 144° | XeF5− | |
| 8 | 0 | 8 | 四方反棱柱形 | XeF82− | ||
| 9 | 0 | 9 | 三侧锥三角柱形 | ReH92− | ||
| 10 | 0 | 10 | 双四角锥反角柱 | Th(C2O4)42− [4] | ||
| 11 | 0 | 11 | 五角锥反角柱 | [ThIV(NO3)4(H2O)3] [4] | ||
| 12 | 0 | 12 | 二十面体 | Mg[Th(NO3)6].8H2O 里的 Th(NO3)62−离子[5] |
参考文献
- ^ McMurry, J. (1992). Organic Chemistry (3rd Edn.), Belmont:Wadsworth. Bibcode:2015JChPh.143k1104C. PMID 26395679. doi:10.1063/1.4931483 .
- ^ 4.0 4.1 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications 编辑
- 分子建模
- 分子力学
- 量子化学
- 价层电子对互斥理论
外部链接