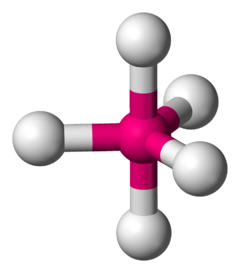
双三角锥形分子构型
化学里的双三角锥形分子构型(trigonal bipyramid)是指分子中心有一个原子,周围有五个原子,以双三角锥的构型和中心原子连结。周围原子和中心原子的键角不完全相同(参照五角双锥形分子构型)。这种分子构形的例子子有气态的五氟化磷 PF5及五氯化磷 PCl5[1]。
| 双三角锥形分子构型 | |
|---|---|
 | |
| 举例 | 五氟化磷、五羰基铁 |
| 点群 | D3h |
| 空间位数 | 5 |
| 配位数 | 5 |
| 键角 | 90°, 120° |
| 极性(μ) | 0 |
轴向及水平面
和中心原子键结的五个原子不完全等价,可以分为两种不同的位子。以五氯化磷为例,磷原子和三个氯原子同一个平面,三个氯原子彼此之间相隔120度,这三个氯原子是在水平面(equatorial)位置,另外二个氯原子不在平面上,是在磷原子的的上方及下方,是在轴向(Axial)位置上。
依照分子构形的价层电子对互斥理论,轴向位置要比水平面位置要拥挤,轴向配体邻近有三个配体与其有90度的夹角,而水平面配体邻近只有二个配体与其有90度的夹角。若双三角锥形分子构型的五个配体均相同,轴向配体的键长会比水平面配体要长,因为轴向配体无法像水平面配体那么接近中心原子。以PF5为例,轴向的P−F键键长为158 pm,水平面的P−F键键长为152 pm。PCl5的轴向键键长及水平面键键长分别是214 pm及202 pm[1]。
在PF3Cl2中,二个氯原子都会在水平面位置上[1],表示氟原子的亲顶性(占轴向位置的倾向)较强,比较容易占据轴向位置。一般而言亲顶性会随电负性而增加,也会随π电子吸收能力而增加,例如Cl < F < CN的例子[2]。两个因素都会降低接近中心原子处的键合区的电子密度,因此轴向位置的拥挤对这些原子影响不大。
有孤电子对时的相关构型
VSEPR理论也有预测一个孤电子对取代配体时的情形,其电子分布不变,不过孤电子对会占据一个配体的位置。若分子的孤电子对和配体加起来共有五个,其电子对分布会和双三角锥形分子构型一样,不过孤电子会在水平面位置上,因此产生的分子构型也会不同。
四氟化硫 SF4的中心原子为硫,周围有四个氟原子,分别在两个轴向位置上以及两个水平面位置上,孤电子对在水平面位置上,依照价层电子对互斥理论,三氟化氯 ClF3属于AX3E2分子,氟原子分别在两个轴向位置上以及一个水平面位置上,两个孤电子对则在水平面位置上。三碘阴离子 I3-也和双三角锥形分子构型有关,但实际分子构型是直线形分子构型,二个碘离子都在轴向位置上,而孤电子对都在水平面位置上(AX2E3)。
贝里假旋转
双三角锥形分子构型会出现贝里假旋转,因此使使分子发生异构化。假旋转类似构象非对映异构体中原子移动的机制,没有完成完整的旋转。贝里假旋转的过程中,二个水平面配体会“移”往分子的轴向,而二个轴向配体会同时“移”往分子的水平面,会产生固定的周期性运动。贝里假旋转在一些简单分子上格外明显,例如五氟化磷 PF5。
相关条目
- 价层电子对互斥理论
- 分子几何
参考资料
- ^ 1.0 1.1 1.2 Housecroft, C. E.; Sharpe, A. G. Inorganic Chemistry 2nd. Prentice Hall. 2004: 407. ISBN 978-0130399137.
- ^ 国际纯化学和应用化学联合会,化学术语概略,第二版。(金皮书)(1997)。在线校正版: (2006–) "Apicophilicity"。doi:10.1351/goldbook.AT06990